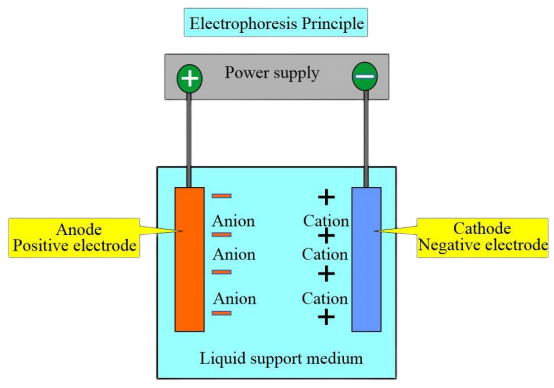
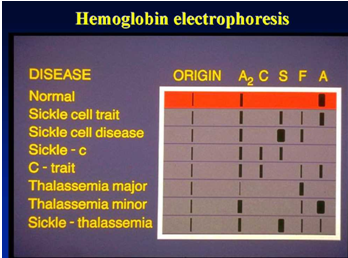
Principe d'expérimentation
L'électrophorèse de l'hémoglobine vise à détecter et confirmer diverses hémoglobines normales et anormales.
En raison des différentes charges et points isoélectriques des différents types d'hémoglobine, dans une certaine solution tampon pH, lorsque le point isoélectrique de l'hémoglobine est inférieur au pH de la solution tampon, l'hémoglobine porte une charge négative et migre vers l'anode pendant l'électrophorèse. A l’inverse, l’hémoglobine chargée positivement se déplace vers la cathode.
Sous une certaine tension et après un temps d'électrophorèse spécifique, les hémoglobines avec des charges et des poids moléculaires différents présentent des directions et des vitesses de migration différentes. Cela permet la séparation de zones distinctes, et une analyse colorimétrique ou électrophorétique ultérieure peut être effectuée sur ces zones pour quantifier diverses hémoglobines. La méthode la plus couramment utilisée est l’électrophorèse sur membrane d’acétate de cellulose à pH 8,6.
Au sein du cytoplasme, les groupes éthylène glycol (CHOH-CHOH) présents dans les substances glycogènes ou polysaccharidiques (telles que les mucopolysaccharides, les mucoprotéines, les glycoprotéines, les glycolipides, etc.) sont oxydés par l'acide périodique et convertis en groupes aldéhyde (CHO-CHO). Ces groupes aldéhyde se combinent avec le réactif de Schiff incolore rouge violacé, formant un colorant rouge violet qui se dépose là où les polysaccharides sont présents dans la cellule. Cette réaction est connue sous le nom de coloration périodique à l'acide de Schiff (PAS), anciennement appelée coloration au glycogène.
Méthode d'expérimentation
Matériels:Acétate de cellulosemoibrane, appareil d'électrophorèse(DYCP-38C et alimentation DYY-6C), Outil de chargement d'échantillons supérieur (pipette), spectrophotomètre, cuvettes colorimétriques, tampons.
Tampon:
(1) Tampon TEB pH 8,6 : peser 10,29 g de Tris, 0,6 g d'EDTA, 3,2 g d'acide borique et ajouter de l'eau distillée à 1 000 ml.
(2) Tampon borate : pesez 6,87 g de borax et 5,56 g d'acide borique et ajoutez de l'eau distillée à 1 000 ml.
Procédure:
Préparation de la solution d'hémoglobine
Prendre 3 ml de sang contenant de l'héparine ou du citrate de sodium comme anticoagulant. Centrifuger à 2 000 tr/min pendant 10 minutes et jeter le plasma. Laver les globules rouges trois fois avec du sérum physiologique (750 tr/min, 5 minutes de centrifugation à chaque fois). Centrifuger à 2 200 tr/min pendant 10 minutes et jeter le surnageant. Ajoutez une quantité égale d’eau distillée, puis ajoutez 0,5 fois le volume de tétrachlorure de carbone. Agiter vigoureusement pendant 5 minutes, puis centrifuger à 2 200 tr/min pendant 10 minutes pour recueillir la solution supérieure d'Hb pour une utilisation ultérieure.
Tremper la membrane
Coupez la membrane d'acétate de cellulose en bandes de 3 cm × 8 cm. Faites-les tremper dans un tampon TEB pH 8,6 jusqu'à saturation complète, puis retirez-les et séchez-les avec du papier filtre.
Repérage
À l'aide d'une pipette, déposez 10 µl de la solution d'hémoglobine verticalement sur la membrane d'acétate de cellulose (côté rugueux), à environ 1,5 cm du bord.
Électrophorèse
Versez la solution tampon de borate dans la chambre d'électrophorèse. Placez la membrane d'acétate de cellulose avec le côté tacheté à l'extrémité cathodique de la chambre. Faites fonctionner à 200 V pendant 30 minutes.
Élution
Découpez les zones HbA et HbA2, placez-les dans des tubes à essai séparés et ajoutez respectivement 15 ml et 3 ml d'eau distillée. Agiter doucement pour éluer complètement l'hémoglobine, puis mélanger.
Colorimétrie
Mettre à zéro l’absorbance en utilisant de l’eau distillée pour la solution d’élution et mesurer l’absorbance à 415 nm.
Calcul
HbA2 (%) = Absorbance du tube HbA2 / (Absorbance du tube HbA × 5 + Absorbance du tube HbA2) × 100 %
Calcul des résultats expérimentaux
Plage de référence pour l'électrophorèse d'acétate de cellulose tampon TEB pH 8,6 : HbA > 95 %, HbA2 1 % -3,1 %
Remarques
Le temps d'électrophorèse ne doit pas être trop long. La membrane d'acétate de cellulose ne doit pas sécher pendant l'électrophorèse. Arrêtez l'électrophorèse lorsque l'HbA et l'HbA2 sont clairement séparées. Une électrophorèse prolongée peut provoquer une diffusion des bandes et un flou.
Évitez d’utiliser trop d’échantillon. Un excès d'hémoglobine liquide peut entraîner un détachement de l'anneau ou une coloration insuffisante, entraînant des taux d'HbA faussement élevés.
Empêcher la contamination de la membrane d'acétate de cellulose par des protéines.
Le courant ne doit pas être trop élevé ; sinon, les bandes d'hémoglobine risquent de ne pas se séparer.
Incluez toujours des échantillons provenant d’individus normaux et les hémoglobines anormales connues nécessaires comme contrôles.
Beijing Liuyi Biotechnology fabrique le réservoir d'électrophorèse professionnel pour l'électrophorèse de l'hémoglobine qui est le modèleDYCP-38CRéservoir d'électrophorèse à membrane en acétate de cellulose, et il existe deux modèles d'alimentation électrique pour électrophorèse disponibles pour le réservoir d'électrophorèse à membrane en acétate de cellulose.DYY-2CetDYY-6Calimentation.
Pendant ce temps, Beijing Liuyi Biotechnology fournit des membranes en acétate de cellulose à ses clients, et la taille de la membrane en acétate de cellulose peut être personnalisée. Bienvenue à nous demander des échantillons et plus d’informations.
La marque Beijing Liuyi a plus de 50 ans d'histoire en Chine et l'entreprise peut fournir des produits stables et de haute qualité partout dans le monde. Grâce à des années de développement, il mérite votre choix !
Nous recherchons maintenant des partenaires, les réservoirs d'électrophorèse OEM et les distributeurs sont les bienvenus.
Si vous avez un projet d'achat pour nos produits, n'hésitez pas à nous contacter. Vous pouvez nous envoyer un message par e-mail[email protégé]ou[email protégé], ou veuillez nous appeler au +86 15810650221 ou ajouter Whatsapp +86 15810650221, ou Wechat : 15810650221
Heure de publication : 20 septembre 2023